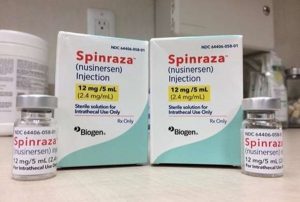
Nesta quarta-feira (28/08), será celebrado o sétimo aniversário de um marco crucial na luta contra a Atrofia Muscular Espinhal (AME) no Brasil. Em 2017, a Anvisa aprovou o SPINRAZA®️ (nusinersena), o primeiro medicamento no país para tratar essa condição devastadora. Para pacientes e suas famílias, essa conquista foi um divisor de águas, oferecendo esperança e tratamentos revolucionários após uma longa batalha por avanços médicos.
A aprovação do SPINRAZA®️ abriu caminho para outros tratamentos inovadores e continua a transformar vidas, simbolizando um triunfo significativo na jornada pela melhoria do cuidado e da qualidade de vida para aqueles afetados pela AME.
É o caso de Renato Trevellin, pai de Gianlucca Trevellin, 11 anos, morador de Santo André e portador da doença rara, que comemora o sucesso do tratamento no Brasil. Segundo ele, este medicamento abriu portas para que outros tratamentos inovadores, como o ZOLGEMSMA e o RISDIPLAN, também fossem incorporados ao SUS. “Essa é uma data muito importante não só para meu filho, que foi a primeira criança do Brasil a receber o tratamento, mas para todos os tratados hoje”, diz.
O progresso foi viabilizado por um robusto processo de revisão, que incluiu documentos, vídeos sobre a evolução dos pacientes e um abaixo-assinado com mais de 100 mil assinaturas. “Nossa história de luta nasce neste tratamento que foi nossa única esperança após muitos médicos desacreditarem da evolução e melhora do meu filho”, enfatiza Renato.
Segundo o Ministério da Saúde, o tratamento consiste na administração de seis frascos com 5ml no primeiro ano e, a partir do segundo ano, três frascos.
“Este dia não apenas celebra a introdução de tratamentos revolucionários, mas também representa a vitória sobre o pessimismo e a desinformação que cercavam a AME. Após mais de 120 anos de pesquisas, a mensagem é clara: a AME tem tratamento e a luta por dignidade e respeito continua”.
Eficácia do medicamento
Para a comprovação de segurança e eficácia do medicamento, foram apresentados no dossiê de registro do remédio, dentre outros documentos, relatórios de estudos não clínicos (tais como testes realizados em células e modelos animais) e relatórios de estudos clínicos (em seres humanos) fase I, II e III.
Adicionalmente, foram avaliados dados de tecnologia farmacêutica como produção, controle de qualidade, validações analíticas, informações do fármaco e dos excipientes e estudos de estabilidades, dentre outros.
Embora o Spinraza já tivesse registro nos EUA, a avaliação da Anvisa se fez necessária, inclusive no que diz respeito a questões específicas e características da população brasileira. A análise técnica da Agência para concessão de registro levou em conta aspectos específicos relacionados a um determinado medicamento, considerando indicação(es), concentração, forma farmacêutica e forma de uso e população-alvo para a qual foram apresentadas as evidências clínicas de segurança e eficácia, além dos aspectos de qualidade.
 RD – Jornal Repórter Diário Notícias sobre o ABC. Santo André, São Bernardo, São Caetano, Diadema, Mauá, Ribeirão Pires e Rio Grande da Serra
RD – Jornal Repórter Diário Notícias sobre o ABC. Santo André, São Bernardo, São Caetano, Diadema, Mauá, Ribeirão Pires e Rio Grande da Serra